Ca2+?EDTA滴定の滴定曲線を描く方法について考えまんねん。いっちゃんはじめに、EDTAの酸解離だけを考慮した場合の滴定曲線を描きまんねん。ついで、Ca2+の加水分解(CaOH+の錯生成)も考慮に入れてもうちびっと厳密な計算をして滴定曲線を描きまんねん。
EDTAの酸塩基反応だけを考慮した場合
前回(2024-05-05)述べたように、Ca2+とEDTA(Y4-)の錯生成反応および錯生成定数Kfは次の通りや。
Ca2+ + Y4- ? CaY2-
Kf = [CaY]/([Ca][Y])
一方、Y4-は塩基としての性質を持ち、酸塩基反応によりY4-, HY3-, H2Y2-,
H3Y-, H4Yの化学種が溶液のpHに応じてある割合で生じまんねん。こないな風な、対象とする主反応(錯生成反応)以外の反応は副反応と呼ばれはります。
Ca2+と反応しておらへんEDTAの全濃度を[Y’], Y4-の存在分率をfy(=f0)とすると、次の関係が成立しまっせ。
[Y’] = [Y]+[HY]+[H2Y]+[H3Y]+[H4Y]
fy = [Y]/[Y’]
存在分率fyは[H]のみの関数や。したがちう、ここでもしpHが一定やったらば、fyは定数となるんですわ。このとき、
Kf = [CaY]/([Ca][Y]) = [CaY]/([Ca][Y’]fy)
ここで、KffyをKf’とすると、
Kf’ = [CaY]/([Ca][Y’])
Kf’は条件生成定数と呼ばれはります。
Cmo
mol/LのCa2+を含む溶液Vmに緩衝液を加えてpHを一定して体積をV mLにしたあと、Cyo mol/LのEDTAで滴定したとき(滴下量:T
mL)の滴定曲線を求めまんねん。ここではEDTAの酸塩基反応だけを副反応として考慮しまっせ。
滴定の各段階における被滴定溶液中のCa2+の全濃度をCm mol/L,
EDTAの全濃度をCy mol/Lとすると、滴定中次の関係が成立しまっせ。
Cm = CmoVm/(V+T) = [Ca]+[CaY]
Cy = CyoT/(V+T) = [Y’]+[CaY]
以上の関係式から、次のような滴下量Tと[Ca]の関係式が成立します(2024-05-05)。
[Ca]2+(Cy?Cm+1/Kf’)[Ca]?Cm/Kf’ = 0
この二次方程式を解いて[Ca]を求めまんねん。
[Ca] = {(Cm?Cy?1/Kf’)+√((Cm?Cy?1/Kf’)2+4Cm/Kf’)}/2 …?
pCa=?log[Ca]を求め、T-pCaの滴定曲線を描きまんねん。
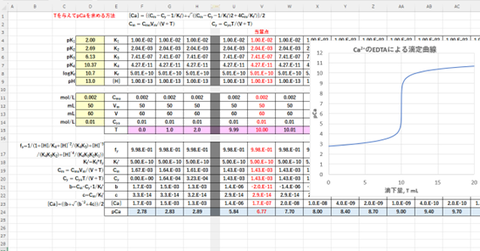
例題1 Cmo=0.002
mol/LのCa2+イオンを含む溶液Vm=50
mLにpH緩衝液(KOH)を加えてV=60 mLにした後、Cyo =0.01 mol/LのEDTAで滴定するっちうとき(滴下量:T
mL)の滴定曲線(T-pCa)を求めよ。pHは13.0とするちうわけや。CaOH+の生成は考慮せん。
用いた平衡定数は次の通り(イオン強度μ=0.1のときの値)。
・EDTA(H4Y)の酸解離定数:
K1 = [H][H3Y]/[H4Y] , pK1 = 2.00
K2 = [H][H2Y]/[H3Y] , pK2 = 2.69
K3 = [H][HY]/[H2Y] , pK3 = 6.13
K4 = [H][Y]/[HY] , pK4
= 10.37
・Ca-EDTA錯体の錯生成定数:
Kf = [CaY]/([Ca][Y]) , logKf = 10.7
これらの値から、pH = 13.0におけるfyおよび条件生成定数Kf’は、
fy = [Y]/[Y’] = 1/(1+[H]/K4+[H]2/(K4K3)+[H]3/(K4K3K2)+[H]4/(K4K3K2K1))
= 0.998
Kf’ = [CaY]/([Ca][Y’])
= Kffy , logK f’ = 10.65
となるちうわけや。
?式およびpCa=?log[Ca]から、エクセルを用いてTに対するpCaを求めたちうわけや。結果を図-1に示す。
EDTAの酸解離およびCaOH+の錯生成を考慮した場合
前項ではEDTAの酸塩基反応だけを副反応としたんやが、ここではEDTAの酸塩基反応に加えてCaOH+の錯生成反応(加水分解)も考慮に入れはります。したがちう、前項の関係式のうち、Cmについては、
Cm = CmoVm/(V+T) = [Ca]+[CaOH]+[CaY]
Ca-OH錯体の生成定数をβoとすると、
βo = [CaOH]/([Ca][OH])
Cm = [Ca](1+βo[OH])+[CaY]
が成立しまっせ。
Y4-と反応しておらへんカルシウムの全濃度を[Ca’]とし、Ca2+の存在分率をfmとすると、
[Ca’] = [Ca]+[CaOH] = [Ca](1+βo[OH])
fm = [Ca]/[Ca’] = 1+βo[OH]
このとき、
Kf = [CaY]/([Ca][Y]) = [CaY]/([Ca’]fm[Y’]fy)
Kffmfy = [CaY]/([Ca’][Y’])
ここで、KffmfyをKf’’とすると、
Kf’’ = [CaY]/([Ca’][Y’])
Kf’’はEDTAの副反応に加えてCaOH+の生成による副反応も含めた条件生成定数や。fmもまた[H]のみの関数や。
被滴定溶液中のCa2+の全濃度をCm mol/L,
EDTAの全濃度をCy mol/Lとすると、滴定中次の関係が成立しまっせ。
Cm = CmoVm/(V+T) = [Ca’]+[CaY]
Cy = CyoT/(V+T) = [Y’]+[CaY]
以上の関係式から、滴下量Tと[Ca’]の関係式が求まるんや(*1)。
[Ca’]2+((Cy?Cm)+1/Kf’’)[Ca’]?Cm/Kf’’ = 0
[Ca’] = {(Cm?Cy?1/Kf’’)+√((Cm?Cy?1/Kf’’)2+4Cm/Kf’’)}/2 …?
(*1) ?式は?式の[Ca], Kf’をそれぞれ[Ca’], Kf’’に置き換えれば、式は同じ形となるちうわけや。
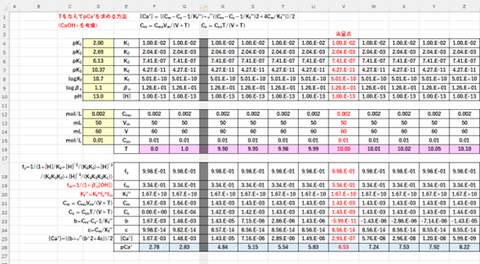
例題2 例題1と同じ条件で、Ca2+をEDTAで滴定するっちうとき(滴下量:T
mL)の滴定曲線(T-pCa’)を求めよ。せやけど、CaOH+の生成を考慮するちうわけや。
・EDTA(H4Y)の酸解離定数:
pK1 = 2.00
pK2 = 2.69
pK3 = 6.13
pK4 = 10.37
・Ca-EDTA錯体の生成定数:
logKf = 10.7
・Ca-OH錯体の生成定数:
βo = [CaOH]/([Ca][OH]), logβo =
1.1
・水のイオン積: pKw
= 13.8
関係式は、
Kf’’ = [CaY]/([Ca’][Y’]) = Kf(fmfy)
Cm
= CmoVm/(V+T) = ([Ca]+[CaOH])+[CaY] = [Ca’]+[CaY]
Cy
= CyoT/(V+T) = [Y’]+[CaY]
fm = [Ca]/[Ca’] = 1/(1+βo[OH]) = 1/(1+βoKw/[H])
fy = [Y]/[Y’]
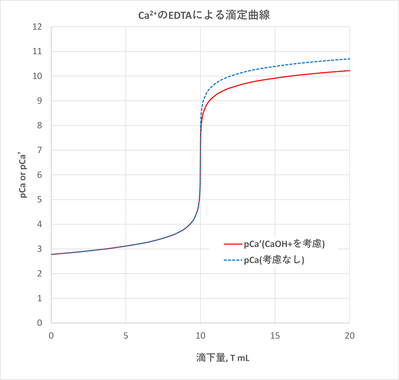
?式およびpCa’=?log[Ca’]から、エクセルを用いてTに対するpCa’を求めたちうわけや。計算結果を図-2に示し、滴定曲線を図-3に示す(赤色の実線)。図-3中には例題1の結果も示す(青色の点線)。
CaOH+を考慮すると、考慮せなきに比べて、当量点後にEDTAと未反応のCa量が増加する(pCa’が減少する)ことが分かるんや。
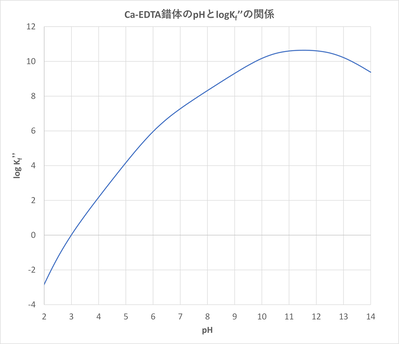
pHによるK''および滴定曲線の変身
Ca-EDTA錯体の条件生成定数Kf’’の関係式は次の通りや。
Kf’’ = [CaY]/([Ca’][Y’]) = Kffmfy
fy = [Y]/[Y’] = 1/(1+[H]/K4+[H]2/(K4K3)+[H]3/(K4K3K2)+[H]4/(K4K3K2K1))
fm = [Ca]/[Ca’] = 1/(1+βo[OH])
= 1/(1+βoKw/[H])
この式で、fmおよびfyはpHの関数やから、Kf’’はpHによって変身しまっせ。
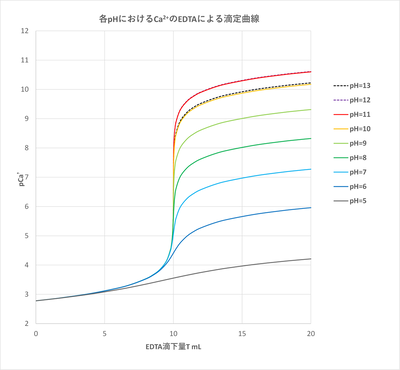
条件生成定数(Kf'')とpHの関係を図-4に示しまっせ。また、pHを変身させたときの滴定曲線の様子を図-5に示します(*2)。
(*2) 図-5は図-2に示したエクセルシートから、What-If分析のデータテーブル機能を用いて作成したちうわけや。
滴定精度を向上させるためにはKf’’が大きなるpHを選ぶ必要がおます。EDTAによってCa2+を滴定するっちうときの最適pHは10?13程度であることが分かるんや。
コメント