カドミウムイオン(Cd2+)は塩化物イオン(Cl-)と塩化物錯体(CdCl+,
CdCl2, CdCl3-, CdCl42-)を作るんや。このCd-Cl錯体の平衡、特にイオン強度の大きな溶液中での活量係数を考慮した平衡について調べまんねん。
<<平衡式、生成定数および化学種濃度>>
前提として十分な酸が加えられててCdの水酸化物錯体は生成せんもんとしまっせ。
Cd-Cl錯体の平衡式は、
Cd2+ + Cl- ? CdCl+
Cd2+ + 2Cl- ? CdCl2
Cd2+ + 3Cl- ? CdCl3-
Cd2+ + 4Cl- ? CdCl42-
全生成定数は、
β1 =
[CdCl]/([Cd][Cl])
β2 = [CdCl2]/([Cd][Cl]^2)
β3 = [CdCl3]/([Cd][Cl]^3)
β4 = [CdCl4]/([Cd][Cl]^4)
カドミウムの全濃度をCMとすると、物質バランスは、
CM = [Cd]+[CdCl]+[CdCl2]+[CdCl3]+[CdCl4]
= [Cd](1 + β1[Cl] + β2[Cl]^2 + β3[Cl]^3 + β4[Cl]^4) = [Cd]αM
ここで、αM = 1 + β1[Cl] + β2[Cl]^2 + β3[Cl]^3 + β4[Cl]^4
それぞれの化学種の濃度は、
[Cd] = CM/αM
[CdCl] = β1[Cd][Cl]
[CdCl2] = β2[Cd][Cl]^2
[CdCl3] = β3[Cd][Cl]^3
[CdCl4] = β4[Cd][Cl]^4
となるんですわ。
したがちう、CMと[Cl]が決まればCd2+およびCd-Cl錯体濃度が分かるんや。(*1)
(*1) もし全塩化物濃度(CCl)に対する各濃度の関係を知りたければ、塩化物の物質バランスを追加する必要があるんや。CCl = [Cl]+[CdCl]+2[CdCl2]+3[CdCl3]+4[CdCl4]
<錯生成定数と濃度分布図>
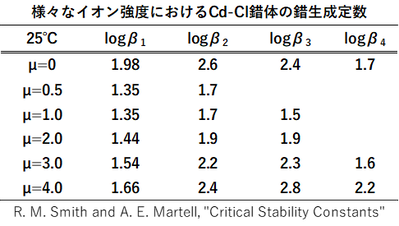
様々なイオン強度における錯生成定数の値を図-1に示します(出典:R. M. Smith and A. E. Martell, "Critical Stability
Constants")。
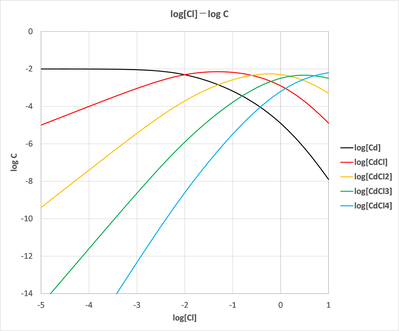
イオン強度μ=0における平衡定数値を用いて、CM=0.01
mol/Lのときの[Cl]に対する各化学種の濃度をエクセルで計算して、log[Cl]?logCの濃度分布図を求めたんや(図-2)。
<<活量係数の考慮>>
図-2では、濃度平衡定数はイオン強度μ=0の値を用おったんやけど、イオン強度の大きな溶液においては、イオン強度の変身によって、濃度平衡定数は大きく変わるんや。したがってこないな風な場合、イオン強度による補正が必要となるんですわ。
これまで、イオン強度による補正には拡張デバイ・ヒュッケル式(2023-03-26),
(2023-08-27), (2024-02-18)を用いてきましたのやが、イオン強度が0.1くらいを超えるとしだいに不正確になるんですわ。それ以上のイオン強度範囲では、デービス式が有効と言われとりまんねん。活量係数をγ, イオン強度をμ, 電荷をzとすると、デービス式は次式のように表されはります。
logγz = ?0.5×z^2×(√μ/(1+√μ)?0.2μ)(*2) …?
(*2) ケツの項は0.2?の代わりに0.3?が用いられはることも多いちうわけや。
<デービス式>
デービス式を用おったときのlogγzの式は次の通りや。
1価イオンでは、
logγI= ?0.5(√μ/(1+√μ)?0.2μ)
2価イオンでは、
logγ?= ?0.5×4×(√μ/(1+√μ)?0.2μ) = 4logγI
なお、電荷を持たへん化学種の場合、logγ0=0となるんですわ。
したがちう、Cd-Cl錯体の錯生成定数(β1?β4)は、次のように表せまんねん。
<β1>
β1 = β1o/(γCdCl+/(γCd++γCl-))
logβ1 = logβ1o?logγCdCl++logγCd+++γCl-
logγCdCl+ = ?0.5×1×(√μ/(1+√μ)?0.2μ) = logγI
logγCl- = ?0.5×1×(√μ/(1+√μ)?0.2μ) = logγI
logγCd++ = ?0.5×4×(√μ/(1+√μ)?0.2μ) = logγII = 4logγI
∴ logβ1 = logβ1o+4logγI
<β2>
β2 = β2o/(γCdCl2/(γCd2+γCl-^2))
logβ2 = logβ2o?logγCdCl2+logγCd+++2γCl-
logγCdCl2 = 0
logγCd = logγII= 4logγI
logγCl = logγI
∴ logβ2 = logβ2o+6logγI
<β3>
β3 = β3o/(γCdCl3-/(γCd++γCl-^3))
logβ3 = logβ3o?logγCdCl3-+logγCd+++3γCl-
logγCdCl3- = logγI
logγCd++ = logγII = 4logγI
logγCl- = logγI
∴ logβ3 = logβ3o+6logγI
<β4>
β4 = β4o/(γCdCl4--/(γCd++γCl-^4))
logβ4 = logβ4o?logγCdCl4--+logγCd+++4γCl-
logγCdCl4-- = logγII = 4logγI
logγCd++ = logγII = 4logγI
logγCl- = logγI
∴ logβ4 = logβ4o+4logγI
<デービス式の有効性>
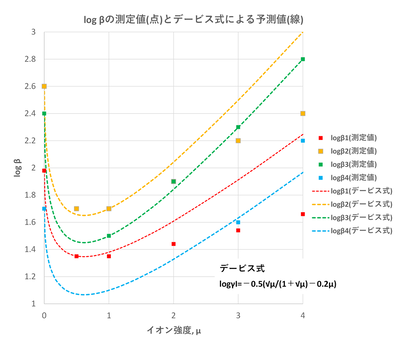
測定値(点)とデービス式?による予測値(破線)の関係を図-3に示しまっせ。
図-3から明らかいなように、β1, β2, β3について、イオン強度が?=1くらいまでは測定値とデービス式?による予測値の間にはほぼええ一致が見られはります。β3は?=1以上でもよい一致を示してるんやが、β1, β2は?=1以上になると乖離が大きなるようや(β4はデータ不足であるが一応の一致が見られはる)。
<より広範に適用可能な補正式の検討>
イオン強度が1を超えても適用できるようなデービス式の補正を検討しまっせ。デービス式に補正項を加えて次のようなモデル式を考えまんねん。ここで、pは補正係数や。
logγz = ?0.5×z^2×(√μ/(1+√μ)?0.2μ?pμ^2) …?
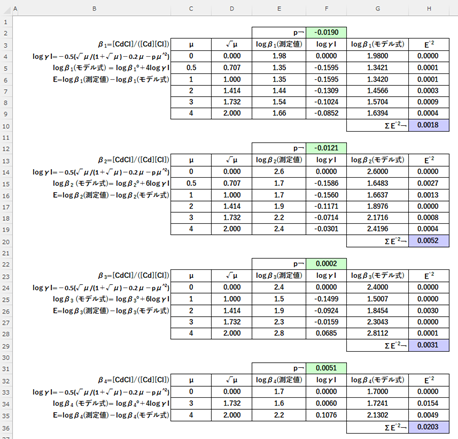
各βについて、最小二乗法(*3)によりlogβの測定値(図-1)とモデル式?から求めたlogβの偏差平方和(?E^2)が最も小さなるようなpの値を求めまんねん。
(*3) 測定値と予測値の誤差の二乗和が最小になるように予測値の未知のパラメーターを求める方法。
E = logβ(測定値)?logβ(モデル式)
?E^2 = ?(logβ(測定値)?logβ(モデル式))^2
エクセルのソルバーによって?E^2が最小となるようなpを求めまんねん。
目的セル:偏差平方和(?E^2) (目標値:最小値)
変数セル:p
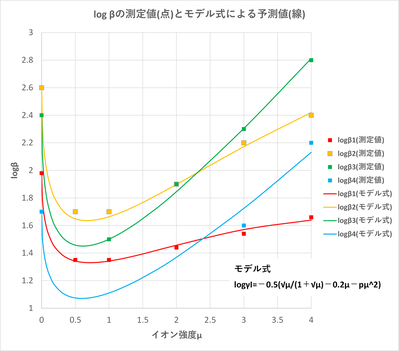
ソルバーの計算結果(p:緑色のセル)を図-4に示しまっせ。logβの測定値(点)とソルバーで求めたpを用いたモデル式?による予測値(実線)の関係を図-5に示しまっせ。このモデル式?は、β1, β2, β3について、イオン強度が?=4まで測定値とよう一致してるんや。
図-4
コメント